Les hémocultures sont des examens biologiques réalisés pour identifier les micro-organismes pathogènes présents dans le sang. Les hémocultures jouent un rôle dans le diagnostic et le traitement des infections sévères, telles que les endocardites, dont la prise en charge immédiate réduit la mortalité de manière significative. En effet, le retard d’administration d’une antibiothérapie adéquate dans le cadre d’un sepsis est directement lié à l’augmentation du taux de mortalité.1.2
L’infirmier(e) est en général le premier professionnel de santé à détecter les signes cliniques et est responsable du prélèvement correct et opportun des hémocultures. Le prélèvement d’hémocultures est un acte courant pour les soignant(e)s. Des prélèvements inappropriés peuvent conduire à des diagnostics erronés3, prolonger la durée d’hospitalisation du patient et augmenter le coût des soins, d’autant plus que les méthodes d’hémoculture ont considérablement évolué au cours des 20 dernières années.4
Dans une étude, 66 % des étudiant(e)s infirmier(e)s (ESI) considèrent que la formation sur le prélèvement des hémocultures devrait être à la fois théorique et pratique à l’IFSI, alors que 28 % déclarent ne pas connaître l’existence des recommandations et des protocoles de prélèvement d’hémocultures. 12 % mentionnent qu’ils n’avaient pas connaissance de l’existence d’un protocole lors de leurs stages.5 Cette analyse met en évidence un besoin de formation approfondie des étudiant(e)s en soins infirmiers.
Ce guide infirmier vous permettra d’approfondir vos connaissances sur l’ensemble du processus lié aux hémocultures, depuis les conditions de prélèvement jusqu’à l’interprétation des résultats. Bien qu’il s’appuie sur les recommandations les plus récentes, il faut toujours respecter en priorité le protocole en vigueur dans votre établissement de santé.
Qu’est-ce qu’une hémoculture ?
Le sang est un milieu normalement stérile.3 Une bactériémie survient lorsque des bactéries se déversent dans le sang depuis un site infectieux initial, également désigné « porte d’entrée ». Une fois dans la circulation sanguine, ces agents infectieux se propagent, atteignent et infectent d’autres parties du corps, nommées foyers secondaires ou métastases septiques. La bactériémie peut être transitoire, intermittente ou continue.6
D’un point de vue clinique, les bactériémies peuvent passer inaperçues ou se manifester par un spectre de syndromes infectieux allant de formes légères jusqu’au choc septique.3
L’hémoculture est un examen biologique diagnostique essentiel dans ce contexte.3.7
Une hémoculture permet de cultiver un échantillon du sang circulant pour isoler et identifier l’agent infectieux responsable d’une bactériémie ou d’une fongémie, prescrite lorsque des signes cliniques évoquent un syndrome infectieux. 3.7.8.9.10. La culture du sang aide à déterminer la sensibilité de l’agent infectieux aux antibiotiques ou aux antifongiques, ce qui guide le choix du traitement approprié.
Une « paire » d’hémocultures se réfère à la collecte de deux échantillons de sang du patient. Les hémocultures sont en effet toujours prélevées par deux : 1
- Flacon aérobie : conçu pour les bactéries qui nécessitent de l’oxygène pour se développer. Souvent identifié par une étiquette bleue ou verte. Le sang y est cultivé pour permettre la multiplication des bactéries aérobies.
- Flacon anaérobie : destiné aux bactéries qui se développent sans oxygène. Marqué généralement d’une étiquette rouge ou marron, ce flacon est utilisé pour cultiver des bactéries anaérobies à partir du sang.11

Les objectifs des hémocultures sont les suivants : 3.6.7
- Identification de germes.
- Détermination du diagnostic.
- Réalisation d’un antibiogramme ou d’un antifongigramme.
- Adaptation du traitement.
Indications des hémocultures
Voici une liste d’indications pour prélever des hémocultures :
- Sepsis sévère et choc septique : suspicion de réaction systémique grave à une infection.6.7.9.12
- Syndrome infectieux non spécifique : présence de symptômes généraux d’infection sans cause évidente.7
- Fièvre inexpliquée persistante : température corporelle supérieure à 38,5°C sans cause identifiée ou hypothermie sévère.6.7.8.9.10.13.14.15
- Facteurs de risque d’infection fongique invasive : patients sensibles aux infections fongiques en raison de leur état ou de traitements spécifiques.7
- Surveillance de patients à haut risque : incluant les patients en aplasie, les femmes enceintes, les nouveau-nés et les patients immunodéprimés.7.9.13
- Épisodes fébriles chez les patients avec dispositifs médicaux invasifs (cathéters, prothèses).
- Endocardite infectieuse : suspicion basée sur les symptômes cliniques et/ou les antécédents médicaux.7.9.13
- Suspicion de complications à partir d’un foyer infectieux localisé (ex. : abcès, infections dentaires).
- Recherche d’une bactérie particulière (Brucella, Lister…)
- Contrôle après traitement antibiotique, en particulier en ce qui concerne les infections endovasculaires et l’endocardite.14
- Nouvel épisode fébrile après une période d’apyrexie de 72 heures.14
- Hypothermie (≤ 36°C). 6.13.15
- En cas de suspicion de tuberculose disséminée ou de mycobactériose atypique.11
Il est important de noter qu’il ne faut pas prélever systématiquement des hémocultures sans évaluation clinique appropriée.16
Contre-indications des hémocultures
Lorsque l’on réalise un prélèvement pour hémocultures, certaines situations imposent des précautions liées à la technique de ponction veineuse. Il ne s’agit pas de contre-indications à l’examen en lui-même, mais de situations dans lesquelles le site de ponction doit être adapté pour garantir la sécurité du patient et la fiabilité du prélèvement. Ainsi, en cas de contre-indication sur un bras, le prélèvement reste possible sur l’autre membre ou sur un site alternatif.
Voici les situations à éviter pour choisir un site de ponction approprié :
- Côté d’un curage ganglionnaire : éviter de réaliser le prélèvement sur le bras du côté où un curage ganglionnaire a été effectué pour réduire le risque de lymphœdème ou d’autres complications.
- Fistule artério-veineuse (FAV) : ne pas prélever sur un bras présentant une fistule artério-veineuse utilisée pour l’hémodialyse afin de préserver la fonctionnalité de la fistule.
- Bras hémiplégique : éviter le prélèvement sur le bras affecté par une hémiplégie pour diminuer le risque de blessure ou d’infection dans une zone à sensibilité réduite.
- Lésion cutanée : ne pas réaliser de prélèvement à travers des lésions cutanées, des infections ou des ecchymoses pour éviter la contamination de l’échantillon et la propagation de l’infection.7
Cadre législatif encadrant le prélèvement d’hémocultures
Voici les points essentiels relatifs à la législation française :
“L’infirmier ou l’infirmière est habilité à pratiquer les actes suivants soit en application d’une prescription médicale ou de son renouvellement par un infirmier exerçant en pratique avancée dans les conditions prévues à l’article R. 4301-3 qui, sauf urgence, est écrite, qualitative et quantitative, datée et signée, soit en application d’un protocole écrit, qualitatif et quantitatif, préalablement établi, daté et signé par un médecin :
(…) 35° Prélèvements de sang par ponction veineuse ou capillaire ou par cathéter veineux” 17
En revanche, le référentiel de compétences permet à l’infirmier(e) d’agir sur son rôle propre à un certain niveau : 18
- Identifier et surveiller les signes cliniques, locaux ou généraux, ainsi que les paramètres vitaux indiquant une infection.
- Évaluer la sévérité de l’état du patient et alerter le médecin si nécessaire.
- Mettre en œuvre les prescriptions médicales ou suivre les protocoles de soins, y compris la réalisation de prélèvements microbiologiques.
L’infirmier(e) en pratique avancée est autorisé(e) à prescrire certains examens de biologie médicale pour les pathologies qu’il/elle suit, sous certaines conditions. Ces examens comprennent :
- Examen cytobactériologique des urines (ECBU).
- Prélèvements cutanés ou muqueux.
- Hémocultures veineuses périphériques, qui font partie intégrante du bilan infectieux.19
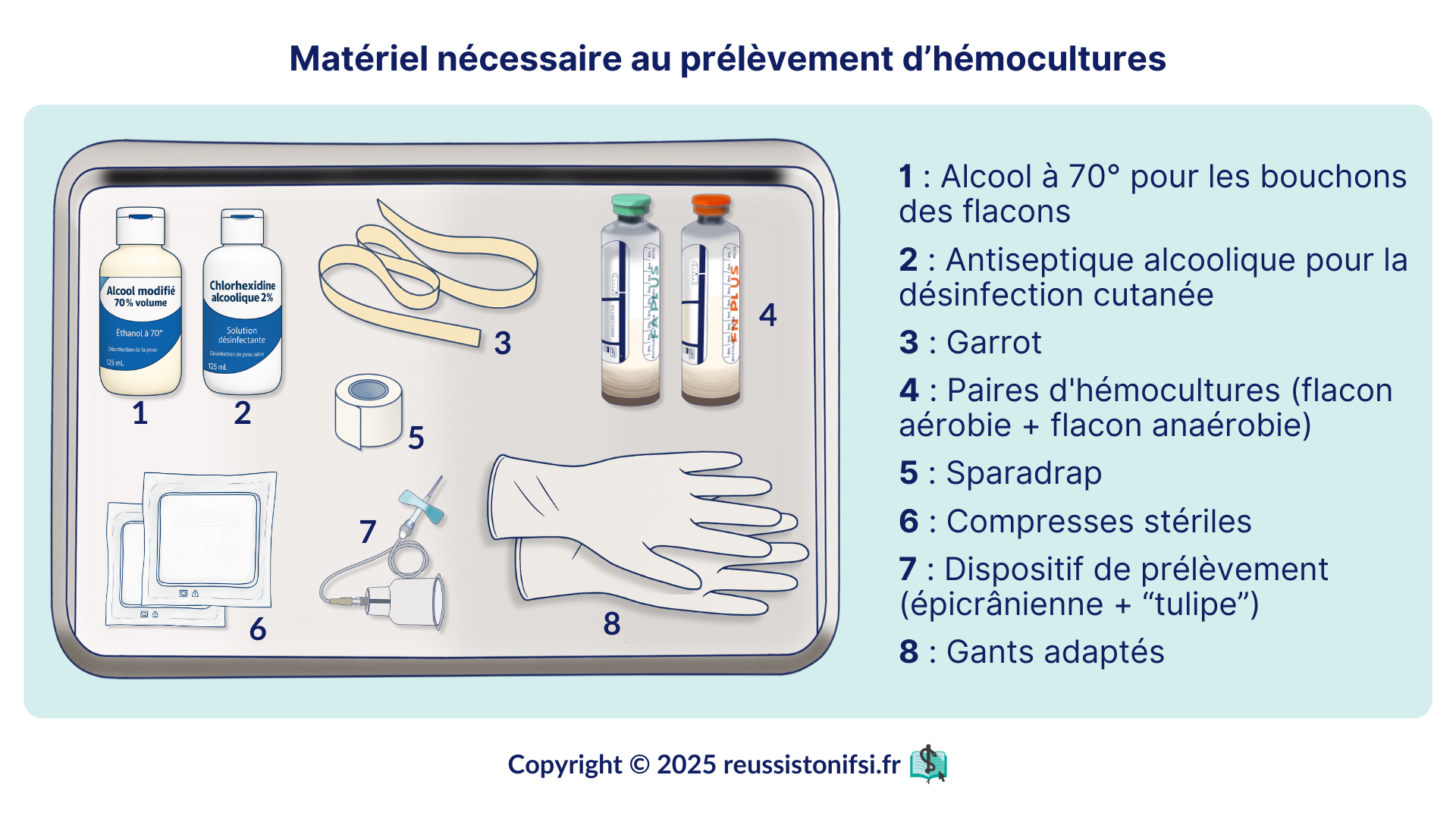
Matériel pour le prélèvement d’hémocultures
Le matériel nécessaire varie selon la méthode de prélèvement (direct ou avec un dispositif intravasculaire comme une VVC ou une CIP, par exemple) et comprend :
Matériel pour le prélèvement direct d’hémocultures : 8.13
- solution hydroalcoolique (SHA),
- compresses stériles,
- Antiseptique alcoolique pour la désinfection cutanée,
- Alcool à 70° pour les bouchons des flacons,
- Gants non stériles,
- Garrot,
- Dispositif de prélèvement (épicrânienne + “tulipe”)
- Paires d’hémocultures (flacon aérobie + flacon anaérobie),
- Adhésif,
- Prescription,
- Etiquettes du patient,
- Pochette de transport,
- Boîte à aiguilles,
- DAOM.
Vous trouverez toutes les informations concernant le prélèvement d’hémocultures sur VVC sur la plateforme Réussis ton IFSI dans le cours dédié aux hémocultures dans l’unité d’enseignement 4.4.
Il faut avant tout : 7.10.11
- Vérifier la date de péremption des flacons de l’ensemble du matériel.
- Contrôler l’intégrité des flacons pour écarter toute présence de fissures, défauts ou signes suspects.
Combien de paires d’hémocultures prélever ?
La sensibilité d’un seul set d’hémocultures étant limitée, les bactéries et champignons n’étant pas toujours présents en continu dans le sang, il est recommandé de prélever un volume total de 40 à 60 mL par épisode suspecté de bactériémie, soit 2 à 3 paires d’hémocultures (correspondant à 4 à 6 flacons) sur une période de 24 heures.3.7.10
En cas d’urgence clinique nécessitant une antibiothérapie rapide, ces prélèvements peuvent être réalisés en une seule fois ou espacés de 30 à 60 minutes.3.7 Cette stratégie permet de maximiser les chances de détection et de prendre en compte les contraintes temporelles liées à la prise en charge du patient.
La sensibilité cumulée d’un diagnostic de bactériémie augmente significativement avec le nombre de sets prélevés : 6
- 73,1 % avec un seul set (environ 20 mL),
- 89,7 % avec deux sets (environ 40 mL),
- 98,3 % avec trois sets (environ 60 mL).
Le prélèvement de quatre sets permet même d’atteindre une sensibilité supérieure à 99 %.
Cependant, dans la majorité des situations cliniques, deux paires d’hémocultures bien réalisées suffisent pour obtenir un bon diagnostic microbiologique, à condition de respecter les volumes et les règles d’asepsie recommandés.10
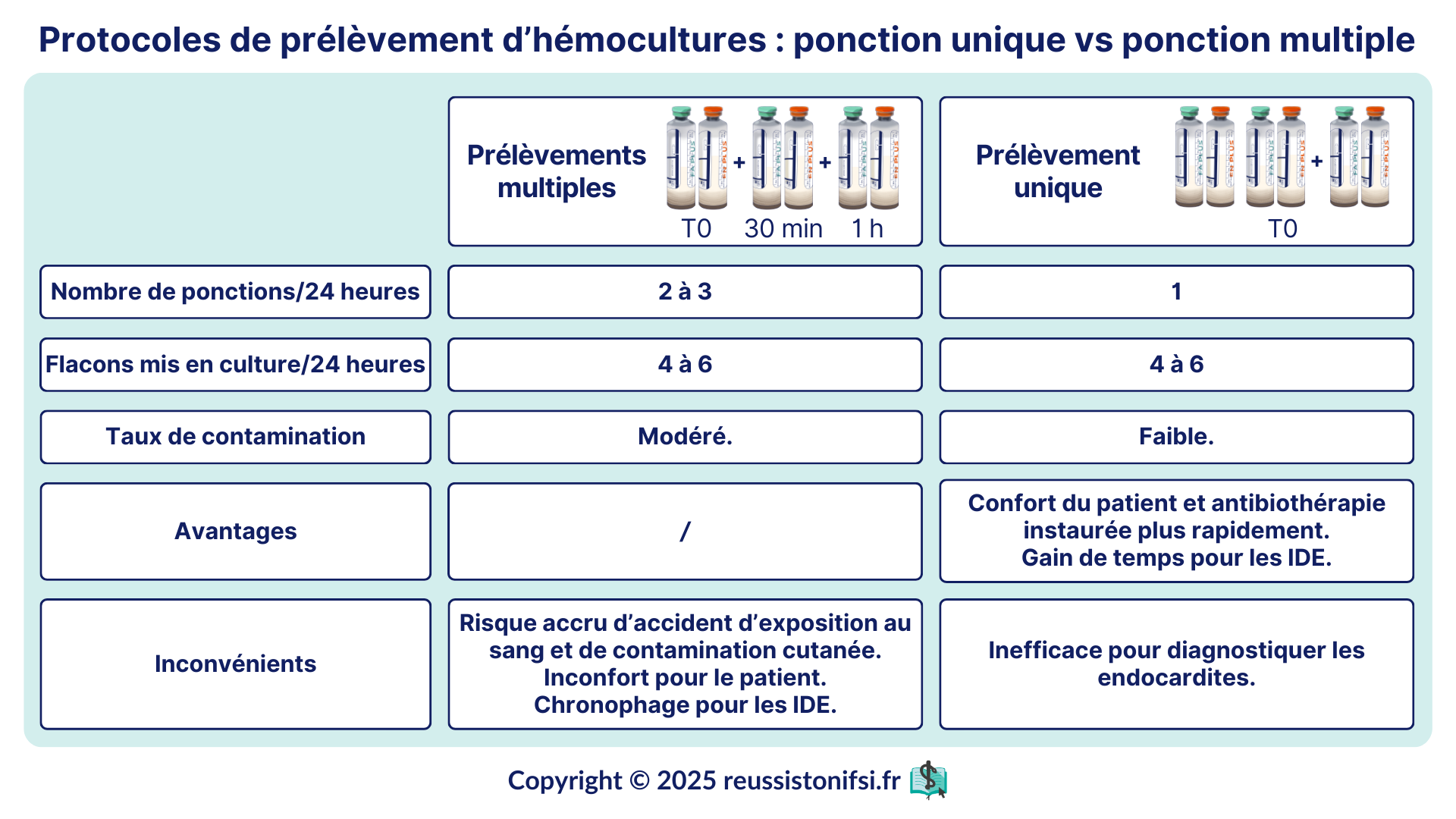
Prélèvement des hémocultures en une ou plusieurs fois ?
Ces prélèvements sont habituellement réalisés en 2 à 3 fois (approche de prélèvement multiple) ou en une seule fois (prélèvement unique).3.10
Traditionnellement, il était recommandé de réaliser les hémocultures lors des pics fébriles, idéalement avant l’administration d’antipyrétiques comme le paracétamol, et lorsque le patient présente des frissons. En effet, c’est à ces moments que la décharge bactérienne dans le sang serait maximale, augmentant ainsi les chances de détection.
Cependant, cette stratégie d’intermittence est aujourd’hui reconsidérée, car les études récentes montrent que, dans la majorité des cas, la bactériémie est continue : les bactéries circuleraient en permanence dans le sang, avec des concentrations variables, mais rarement nulles.20.21.22
Ainsi, l’efficacité du prélèvement repose moins sur le moment exact que sur le volume de sang recueilli, paramètre déterminant pour améliorer la sensibilité de l’hémoculture.
Il s’avère qu’une détection efficace des bactériémies dépend moins du timing du prélèvement que du volume de sang recueilli : prélever un volume de sang entre 40 et 60 mL augmente de manière significative les chances de détecter une bactériémie, indépendamment du moment de prélèvement ou de la concentration bactérienne du sang à cet instant.3.10
En revanche, en cas de suspicion d’endocardite infectieuse, la procédure recommandée est de prélever trois paires d’hémocultures dans les 12 à 24 heures précédant le début de l’antibiothérapie, avec un intervalle d’au moins une heure entre chaque prélèvement, avant l’administration des antibiotiques.
Un suivi quotidien des hémocultures est ensuite nécessaire pour surveiller la persistance de l’endocardite et vérifier l’efficacité du traitement.9.10.11
Ce tableau présente un comparatif des protocoles de prélèvements qui met en évidence les avantages et les inconvénients associés aux méthodes de ponction multiple et de ponction unique.3.6.9
Prélèvement d’hémocultures en 5 étapes
Des erreurs techniques peuvent entraîner des diagnostics erronés et des traitements inappropriés, qui affecteront la durée d’hospitalisation du patient et engendreront des coûts supplémentaires, d’où l’importance d’une méthode rigoureuse dès la préparation du soin.23.24.25
Pour garantir la fiabilité des résultats, plusieurs recommandations doivent être respectées en ce qui concerne le moment du prélèvement, la technique utilisée et les mesures d’hygiène. Voici quelques prérequis avant de présenter le soin étape par étape :
- Idéalement, les prélèvements doivent être réalisés avant le début de toute antibiothérapie ou antimycobactérien3.7.11 , excepté dans les cas urgents comme le purpura fulminans. Si une antibiothérapie est déjà en cours, le prélèvement doit avoir lieu juste avant la dose suivante pour minimiser l’impact de l’antibiotique sur les résultats.3 Il est indispensable de préciser sur le bon de laboratoire si le patient est sous traitement antibiotique, afin d’optimiser l’interprétation des résultats.
- Privilégiez la ponction veineuse directe pour les prélèvements d’hémocultures.
- ⚠️Pour une lecture plus fluide, les étapes de désinfection des mains avec une solution hydroalcoolique, bien qu’essentielles à plusieurs moments du processus, ne seront pas systématiquement répétées dans le texte, mais doivent être rigoureusement appliquées conformément aux pratiques d’hygiène standard.
Vous trouverez toutes les informations concernant le prélèvement d’hémocultures sur VVC sur Réussis ton IFSI dans le cours dédié aux hémocultures dans l’unité d’enseignement 4.4.
Le prélèvement d’hémocultures se déroule en plusieurs étapes pour garantir l’exactitude diagnostique.3.7.8.10.13.14.26
1. Prérequis et identitovigilance
Avant toute réalisation du prélèvement, plusieurs étapes préalables sont indispensables pour garantir la sécurité du soin, le respect du patient et l’efficacité du geste.
Commencez par vérifier la prescription médicale ou le protocole en vigueur dans le service.
Informez le patient de manière claire et bienveillante sur la procédure, en prenant le temps de le rassurer et de répondre à ses éventuelles questions. Cette démarche favorise sa coopération. Confirmez son identité en appliquant la procédure d’identitovigilance de l’établissement, généralement en utilisant des questions ouvertes pour vérifier son nom, son prénom et sa date de naissance. Vérifiez également la concordance entre les étiquettes d’identification et l’identité déclarée par le patient.
Avant de débuter le soin, il est indispensable d’obtenir le consentement libre et éclairé du patient et de prévenir la douleur.
2. Préparation de l’environnement de soin
Une fois le matériel complet et vérifié, la préparation rigoureuse de l’environnement de soin est une étape déterminante. Elle conditionne la qualité de la procédure, le confort du patient, la sécurité sanitaire et l’ergonomie du geste infirmier.
Installez-vous dans un espace calme, propre, bien éclairé, offrant une visibilité optimale et un accès facile à l’ensemble du matériel. Désinfectez ensuite le plan de travail avec un produit conforme à la norme EN 13697, en respectant scrupuleusement le temps de séchage indiqué par le fabricant27 et disposez méthodiquement le matériel nécessaire sur un plateau ou une surface propre, de manière logique et ordonnée. L’objectif est d’éviter les croisements de mains et les gestes parasites qui pourraient compromettre l’asepsie. Cette organisation favorise également une posture stable et confortable pour le/la soignant(e) et limite la fatigue musculaire et les risques d’erreurs.
Adaptez également la position du patient à son état clinique : en position assise ou allongée. Le bras destiné à la ponction doit être parfaitement dégagé (sans vêtement gênant) et reposer sur un support stable, paume tournée vers le haut avec une légère extension du bras pour optimiser la visibilité et l’accès aux veines périphériques.
Dans la mesure du possible, le/la soignant(e) adopte une position assise, à la hauteur adaptée pour avoir une posture ergonomique et stable tout au long de la procédure.
3. Désinfection et asepsie
Pour choisir la veine adaptée, il existe plusieurs méthodes que vous pouvez découvrir dans le guide infirmier : prélèvement sanguin.
- Effectuer l’antisepsie du point de ponction (respect des protocoles locaux validés par le CLIN). La recommandation actuelle privilégie l’emploi d’antiseptiques alcooliques, tels que la chlorhexidine alcoolique, pour l’asepsie du site de ponction.28 Cette préférence est fondée sur des études démontrant l’efficacité supérieure de ces produits par rapport aux antiseptiques non alcooliques, comme la povidone iodée.3
- Suivre une technique aseptique rigoureuse conforme à l’ANTT (Aseptic Non Touch Technique).29
- Enlever les capuchons des hémocultures et désinfecter la zone avec un de l’alcool à 70° et laisser sécher au moins 30 secondes.8
4. Prélèvement du sang
- Respecter l’ordre des tubes si d’autres examens sanguins sont prévus : prélever en priorité les flacons pour hémocultures spécifiques.
- Installer un garrot 5 à 10 cm au-dessus du site de ponction, sans dépasser une durée d’une minute pour éviter l’hémoconcentration.
- Réaliser l’hygiène des mains à l’aide d’une solution hydroalcoolique.
- Mettre des gants à usage unique (conformes à la norme NF EN ISO 37430) ou stériles, selon le protocole de service et notamment si vous devez repalper la veine avant le prélèvement.
- Si vous devez retoucher la zone pour repalper la veine avant le prélèvement, le port de gants stériles est requis afin de maintenir les conditions d’asepsie.
- Tendre fermement la peau avec le pouce quelques centimètres sous le site de ponction pour stabiliser la veine et faciliter l’insertion de l’aiguille.
- Stabiliser le bras du patient si nécessaire, en maintenant l’avant-bras ou le coude pour améliorer le confort et l’efficacité du geste.
- Introduire l’aiguille avec précision, dans le sens du retour veineux, biseau vers le haut, à un angle de 5 à 30°, selon la profondeur de la veine.
- Engager au moins 5 mm de l’aiguille dans la lumière veineuse pour obtenir une bonne stabilité.
- Surveiller l’apparition du reflux sanguin, signe que l’aiguille est bien positionnée, et cesser immédiatement l’avancée pour éviter toute transfixion ou extravasation.
- Maintenir et immobiliser le dispositif de prélèvement avec le pouce et l’index de la main dominante.
- Remplir d’abord le flacon aérobie pour purger la tubulure si le prélèvement concerne une aiguille à tubulure, puis le flacon anaérobie. Pour qu’il ne rentre pas d’air dans les flacons anaérobies.
- Numéroter les flacons d’hémocultures dans l’ordre de prélèvement.15.28
- Respecter le volume optimal de prélèvement : 8 à 10 mL par flacon.10.13.15.28.31.32 Minimum 5 mL chez l’adulte8 et 2 mL chez l’enfant.8.32
- Ne pas dépasser les volumes recommandés, afin d’éviter les faux positifs.28.31
- Desserrer le garrot avant de désadapter le dernier flacon.
- Retirer l’aiguille avec précaution, la jeter immédiatement dans le collecteur sécurisé, puis appliquer une pression sur le site de ponction avec une compresse stérile.
- Retirer les gants avec précaution.
- Réaliser à nouveau une hygiène des mains avec une solution hydroalcoolique.
- Mélanger doucement les flacons en les retournant plusieurs fois : 2 à 4 fois selon les recommandations du fabricant.13.28
5. Finalisation et acheminement des hémocultures
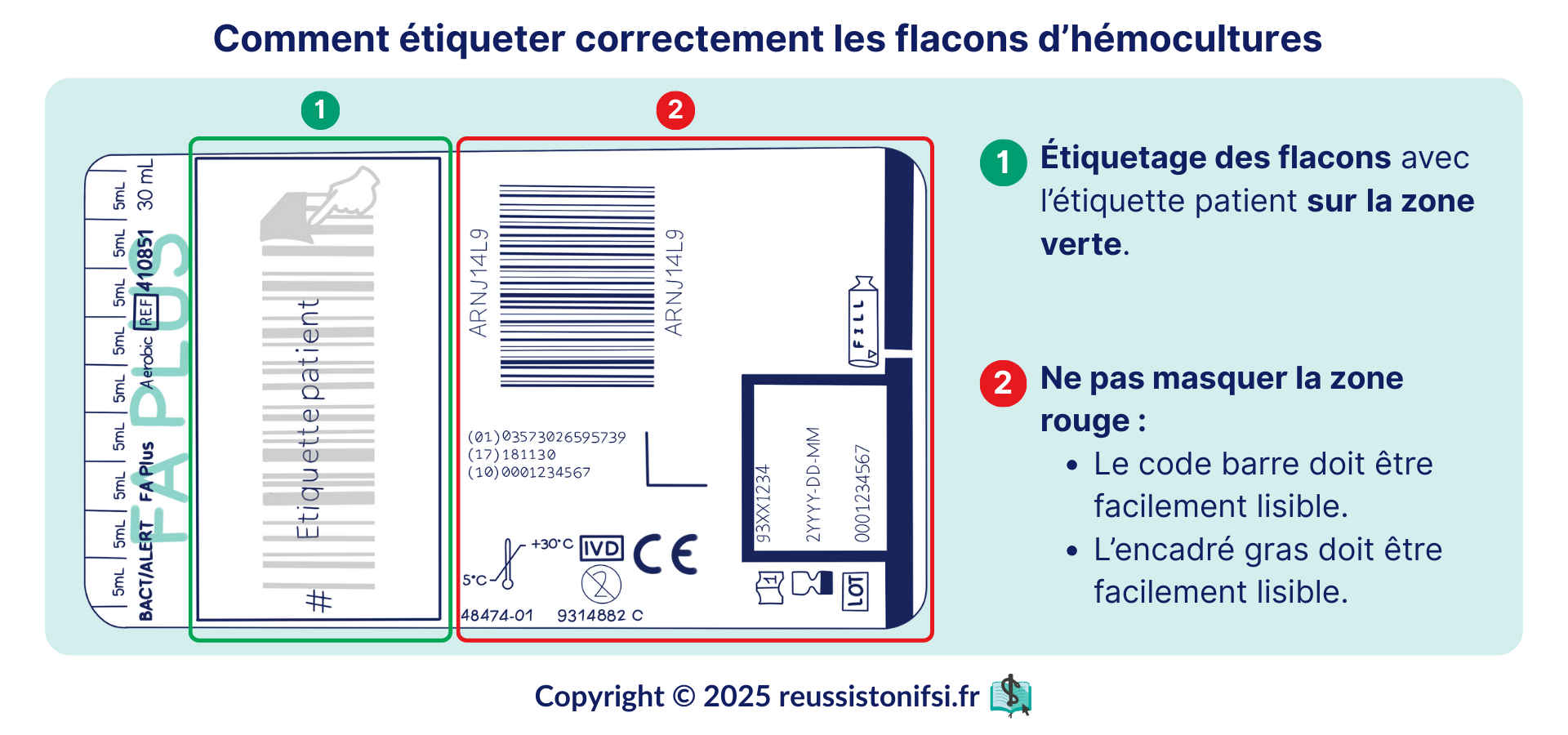
- Éviter de coller l’étiquette patient sur le code-barres ou le QR code du flacon, car ceux-ci contiennent des informations essentielles (numéro de lot, date de péremption).
- Éviter, si possible, de placer l’étiquette sur la zone transparente du flacon, afin de conserver une bonne visibilité du niveau de remplissage.11
- Noter systématiquement les informations suivantes : température du patient au moment du prélèvement, suspicion ou non d’endocardite, éventuelle antibiothérapie en cours, et origine du prélèvement (ponction périphérique, VVP, VVC, Port-à-Cath, etc.).
- Envoyer les flacons au laboratoire dans les deux heures suivant le prélèvement.8 Dans certains laboratoires, l’incubation doit se faire dans les 12 heures suivant le prélèvement. 15.28
- Stocker les flacons en position verticale à température ambiante (15-30 °C), à l’abri de la lumière sauf indication contraire du laboratoire.11.15.28
- Garantir le confort et la sécurité du patient, notamment en vérifiant l’arrêt du saignement, en le réinstallant confortablement et en le remerciant pour sa coopération.
- Évacuer les déchets selon les filières réglementaires (DAOM, DASRI, collecteurs à aiguilles, etc.).
- Renseigner les transmissions dans le dossier de soins, en précisant les conditions du prélèvement, les incidents éventuels, et les informations utiles à l’équipe.
- Assurer une traçabilité complète du soin, conformément aux protocoles de l’établissement.
- Surveiller le site de prélèvement pour toute réaction indésirable et vérifier que les résultats des hémocultures sont suivis attentivement pour une prise en charge adaptée du patient.
Complications et surveillances liées aux hémocultures
Les complications liées au prélèvement d’hémocultures incluent des risques de contamination, d’hématomes et de prélèvements non conformes pouvant entraîner des diagnostics erronés. Des mesures de prévention et des réactions adaptées permettent de maintenir la qualité du diagnostic et la sécurité du patient. Voici un tableau récapitulatif des éventuelles complications, des méthodes de prévention et des actions à entreprendre en cas de leur survenue.7.8
| Complications | Prévention | Conduite à tenir |
| Hématome au niveau du point de ponction | Appliquer une pression suffisante après le prélèvement. | Surveiller le site de ponction pour tout signe de saignement ou de gonflement. Appliquer une pression supplémentaire si nécessaire. |
| Défaut de reflux du sang | Utiliser les techniques de ponction appropriées et vérifier l’équipement avant le prélèvement. | Réajuster la position de l’aiguille ou la repositionner si nécessaire. Envisager d’utiliser une autre veine si le problème persiste. |
| Douleur | Utiliser des techniques douces et rassurer le patient. | Évaluer le niveau de douleur du patient et lui apporter du confort, en utilisant du froid si nécessaire. |
| Malaise vagal | Informer le patient sur ce qui va se passer et l’installer confortablement. | Positionner le patient en sécurité, élever ses jambes si possible et surveiller ses paramètres vitaux. Demander une assistance médicale si le malaise persiste. |
| Ponction artérielle | Identifier correctement les veines et les différencier des artères par palpation. | Arrêter immédiatement de ponctionner, appliquer une pression ferme sur le point d’insertion de l’aiguille et informer le médecin. Surveiller la zone pour détecter tous types de changements possibles. |
| Contamination | Effectuer une asepsie rigoureuse et utiliser des techniques de prélèvement stériles. | Si une contamination est suspectée, répéter le prélèvement et effectuer une désinfection approfondie. Informer le laboratoire pour qu’il soit vigilant lors de l’interprétation des cultures. |
| Faux positifs | Respecter scrupuleusement les protocoles d’asepsie et de prélèvement. | Si nécessaire, répéter le prélèvement. |
| Faux négatifs | Éviter l’administration d’antibiotiques avant le prélèvement et prélever un volume de sang adéquat. | Etudier la nécessité de répéter le prélèvement si les symptômes du patient persistent malgré une culture négative. |
Comprendre les résultats des hémocultures : interprétation et antibiogramme pour les infirmier(e)s
Détection des bactéries après le prélèvement
Une fois les échantillons sanguins prélevés, les flacons d’hémocultures sont placés en incubation à 37 °C pour une durée généralement comprise entre 5 et 7 jours. Cette étape favorise la croissance de micro-organismes éventuellement présents dans le sang du patient. L’incubation est garantie par des automates spécialisés tels que BACTEC™, BacT/ALERT™ ou VersaTREK™, qui surveillent en continu les flacons.
Si des bactéries se développent dans le flacon, elles consomment l’oxygène et produisent du dioxyde de carbone (CO₂). Cette production de CO₂ entraîne une modification du pH, qui provoque à son tour un changement de couleur de la pastille située au fond du flacon. Ce changement est ensuite détecté automatiquement par l’automate d’incubation (signalé par le triangle bleu), indiquant la croissance bactérienne et déclenchant une alerte pour prise en charge au laboratoire.

Chaque flacon contient également un milieu de culture spécifique enrichi en nutriments et un anticoagulant tel que le polyanéthol sulfonate de sodium (SPS), qui limite l’action bactéricide du sérum et peut neutraliser certains antibiotiques à faible concentration. Certaines marques y ajoutent des résines absorbantes ou du charbon activé, pour améliorer la détection en présence de traitement antibiotique.
En cas de croissance bactérienne, l’automate déclenche une alarme, qui signale qu’un flacon est positif. Celui-ci est alors pris en charge par un(e) technicien(ne) de laboratoire. Le contenu est analysé selon un processus en trois étapes :
- Examen microscopique direct, à l’état frais et après coloration de Gram.
- Isolement des bactéries sur milieux de culture adaptés par repiquage.
- Identification du germe, suivie de la réalisation d’un antibiogramme, pour orienter le traitement antibiotique.
Si aucune croissance n’est détectée après cinq jours, l’hémoculture est généralement considérée comme négative3. Toutefois, certaines situations cliniques nécessitent des précautions d’interprétation. Chez les patients immunodéprimés ou opérés récemment, des hémocultures polymicrobiennes peuvent être observées. Dans ces cas, chaque micro-organisme identifié doit être analysé avec prudence, car il peut être pathogène. Chez des patients en phase terminale, la présence de bactéries dans le sang peut aussi traduire une translocation bactérienne, liée à l’altération des barrières naturelles, sans refléter nécessairement une infection active.
L’ensemble de ces analyses microbiologiques repose sur des techniques automatisées fiables, mais leur interprétation clinique reste délicate. La distinction entre une véritable infection et une contamination accidentelle lors du prélèvement requiert une approche rigoureuse, qui intègre les résultats biologiques, le contexte clinique et les données du patient. C’est pourquoi la qualité du prélèvement, le respect des délais d’acheminement et la traçabilité complète sont essentiels pour garantir la fiabilité des résultats et adapter efficacement la prise en charge thérapeutique.
Les hémocultures négatives indiquent généralement l’absence de bactériémie. Néanmoins, il est important de prendre en compte la possibilité de faux négatifs, qui peuvent résulter d’un prélèvement mal chronométré, d’une antibiothérapie préalable, d’un volume insuffisant de sang ensemencé, ou d’un micro-organisme non cultivable. Inversement, les faux positifs, dus à une contamination lors du prélèvement ou à une manipulation inappropriée, nécessitent également une analyse minutieuse pour éviter des interprétations erronées et des traitements inutiles.13
Seule une minorité des hémocultures, environ 5 à 10 %, s’avère positive5. Il est particulièrement difficile de détecter les bactériémies. En cas de positivité, chaque micro-organisme identifié requiert une identification précise et, le cas échéant, un antibiogramme pour déterminer l’approche thérapeutique la plus adaptée.
Si un agent infectieux spécifique, comme le Staphylococcus aureus ou le Pseudomonas aeruginosa, est identifié, même dans un seul flacon positif, cela confirme l’infection et un antibiogramme est systématiquement effectué. En revanche, pour des germes souvent considérés comme contaminants (comme les staphylocoques à coagulase négative), le biologiste doit distinguer une véritable infection d’une simple contamination (aussi appelé un faux positif) au moment du prélèvement. Cette décision se base sur le nombre de flacons positifs pour un patient, le total des hémocultures effectuées, et une évaluation clinique et biologique. Selon ces informations, le biologiste décide de l’opportunité de réaliser un antibiogramme et peut ajouter des commentaires dans le rapport pour aider le/la clinicien(ne) à interpréter les résultats.3
Antibiogramme et antibiothérapie
Un antibiogramme est un test réalisé en laboratoire pour déterminer la sensibilité d’une bactérie à différents antibiotiques. Après avoir isolé le germe responsable de l’infection (par exemple à partir d’une hémoculture positive), on le met en contact avec plusieurs antibiotiques dans un milieu de culture. On observe ensuite la croissance bactérienne autour des disques ou pastilles d’antibiotiques : si une zone sans croissance (zone d’inhibition) apparaît, cela signifie que l’antibiotique est efficace contre cette bactérie. L’antibiogramme permet ainsi de choisir le traitement le plus adapté et d’éviter les résistances inutiles.
Améliorer la qualité des hémocultures grâce à la formation et aux bonnes pratiques
Les hémocultures représentent un outil diagnostique essentiel dans le milieu hospitalier. Elles permettent d’identifier les agents pathogènes responsables de bactériémies et de guider la mise en place d’une antibiothérapie ciblée. La formation continue du personnel soignant est au cœur de cette démarche, elle vise à minimiser les faux positifs, à réduire les coûts de santé et à augmenter le confort du patient.
Le choix de la ponction veineuse périphérique, après une asepsie minutieuse et le prélèvement d’un volume sanguin adéquat, est préconisé pour garantir la fiabilité des résultats. De même, la surveillance régulière des indicateurs de qualité liés au prélèvement des hémocultures et la communication des résultats aux équipes cliniques sont indispensables pour sensibiliser aux pratiques et les améliorer.
Une prescription médicale pertinente, des préleveurs formés, l’adoption du prélèvement unique et un acheminement rapide des échantillons au laboratoire sont les clés d’un diagnostic efficace et fiable des bactériémies.1.3
Si vous aspirez à approfondir votre connaissance du processus infectieux et de la gestion des bactériémies, nous vous invitons à consulter le cours complet dans l’unité d’enseignement 2.5 de notre plateforme : “Le mécanisme de l’infection et ses différents processus”, “Les marqueurs biologiques et les examens dans les infections”, “Les mécanismes inflammatoires”, “L’endocardite infectieuse”. Vous trouverez également, dans l’unité d’enseignement 4.4, des ressources complémentaires dédiées aux hémocultures, qui incluent le cours en résumé audio et des Q.C.M. pour tester vos connaissances.
Conseils d’expert(e)s
LABORDE Marielle
Pendant longtemps, j’ai pensé qu’il fallait réaliser les hémocultures au moment des frissons, sur recommandation d’un médecin. Mais les données récentes montrent que la bactériémie est le plus souvent continue, ce qui rend inutile d’attendre un épisode fébrile ou des frissons pour prélever. L’important reste surtout le volume de sang recueilli et le respect des bonnes pratiques.
BATAILLE Isabelle
Comme pour tout prélèvement, il est important de s’appuyer sur les protocoles du service et du laboratoire concerné. Les hémocultures sont parfois angoissantes pour les patients au vu de la taille des flacons, mais cet acte est “anodin”. Par cela, les traitements seront ajustés et plus efficaces.
Le bon de laboratoire doit être scrupuleusement rempli, pour éviter de recommencer le prélèvement et surtout d’avoir toutes les infos nécessaires pour éviter des erreurs d’interprétation.
PALLIER Aude
Si la technique de prélèvement d’hémocultures reste la même que pour une ponction veineuse plus « classique », 3 points nécessitent toutefois une attention plus particulière :
- Le moment de prélèvement : idéalement pendant des frissons et surtout AVANT l’antibiothérapie qui doit absolument ne pas être commencée.
- Les consignes d’utilisation des flacons d’hémocultures qui doivent être parfaitement comprises et respectées.
- Les règles d’asepsie qui doivent être rigoureusement maîtrisées au risque sinon d’engendrer des faux positifs et donc des retards de prise en charge.
JABRANE Badia
Le prélèvement d’hémocultures est un acte technique infirmier effectué sur prescription médicale ou dans le cadre d’un protocole de service. Il requiert de la rigueur dans l’hygiène des mains du soignant et dans la désinfection du site et des bouchons des flacons avec un antiseptique alcoolique non iodé.
Si vous devez retenir 3 précautions fondamentales :
- L’asepsie rigoureuse est non négociable : une hémoculture contaminée est inutile, voire dangereuse ! De plus, la contamination des flacons est la principale cause de faux positifs !
- Prélever avant l’antibiothérapie et respecter les volumes indiqués : trop peu de sang = risque de faux négatif !! Hémocultures faites trop tard = les antibiotiques faussent les résultats !
- En cas de situation d’urgence : Prenez le temps… même si tout va vite ! Mieux vaut perdre 60 secondes à bien faire que 3 jours à gérer un faux positif !
BENNANI Marouan
Le prélèvement d’hémoculture en laboratoire de ville reste un geste peu fréquent. Comme pour toute procédure inhabituelle, il est important de prendre son temps, relire la procédure du laboratoire, et demander conseil au biologiste ou aux collègues préleveurs si besoin. Mieux vaut consacrer quelques minutes à bien se préparer pour garantir un prélèvement de qualité, même si la salle d’attente est pleine : personne ne vous reprochera d’avoir privilégié la sécurité et la rigueur dans l’intérêt du patient.
Remerciements
Nous tenons à exprimer notre profonde gratitude à Isabelle BATAILLE (cadre de santé et formatrice en IFSI), Marielle LABORDE (formatrice en santé), Aude PALLIER (formatrice et référente en santé), Viviane CASSOTTI (hygiéniste), Badia JABRANE (directrice pédagogique) et Marouan BENNANI (médecin biologiste).
Chez Réussis ton IFSI, nous nous engageons à proposer des contenus d’une fiabilité inégalée. En complément de l’expertise interne de notre équipe habituelle, nous valorisons l’apport de professionnel(le)s extérieur(e)s qualifié(e)s qui enrichissent nos articles de perspectives nouvelles.
Sources
- Revue Médicale Suisse « Détection d’une bactériémie par des hémocultures : qui en bénéficie ? » de Sciotto, Lucie; Abbas, Mohamed; Serratrice, Jacques 12/10/2017
- Seymour CW, Liu VX, Iwashyna TJ, Brunkhorst FM, Rea TD, Scherag A, Rubenfeld G, Kahn JM, Shankar-Hari M, Singer M, Deutschman CS, Escobar GJ, Angus DC. Assessment of Clinical Criteria for Sepsis: For the Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016 Feb 23;315(8):762-74. doi: 10.1001/jama.2016.0288. Erratum in: JAMA. 2016 May 24-31;315(20):2237. PMID: 26903335; PMCID: PMC5433435.
- Aurélie Beaucamp Samson. Étude rétrospective des hémocultures réalisées au CHU de Rouen entre janvier et juin 2017 et analyse de différents indicateurs qualité. Sciences pharmaceutiques. 2019.ffdumas-02283264f
- EM consulte « Actualités sur l’hémoculture » 21/02/2008
- Service d’anesthésie réanimation, Samu de Paris, Hôpital Necker-Enfants malades « Formation des étudiants en soins infirmiers à la réalisation des hémocultures » 06/03/2020
- Biomerieux « Hémoculture, un prélèvement d’urgence dans le diagnostic des infections du sang » 02/12/2020
- Infectiologie CHRU Nancy « Bonnes pratiques de prélèvements – Les hémocultures » 06/07/2015
- CHUV « Hémocultures » 25/10/2021
- Infectiologie « Bonnes pratiques de prélèvement des hémocultures : quand, pour qui, comment ? » 28/03/2023
- Hôpitaux universitaires de Genève « Procédures de soins hémocultures » consulté le 21/03/2024
- CHRU Strasbourg Pôle biologie « PTM – bonnes pratiques de prélèvement des hémocultures » 04/07/2023
- Le manuel MSD « Sepsis et choc septique » 04/2024
- Centre Léon Berard « Prélèvement d’hémocultures » revu le 23/03/2023
- CHU Angers « Bonnes pratiques de l’hémoculture en réanimation » 14/01/2019
- Bio-Val « Fiche de préconisations : prélèvement des hémocultures » consulté le 21/04/2025
- Ministère de la santé, de la jeunesse et des sports « Définition des infections associées aux soins » 22/05/2007
- Code de la santé publique – Article R4311-7 – Version en vigueur depuis le 24 avril 2022
- Ministère du Travail, des Relations sociales, de la Famille, de la Solidarité et de la Ville et ministère de la Santé et des Sports – « Diplôme d’état d’infirmier référentiel de compétences » 16/10/2009
- Code de la santé publique – Article R. 4301-3 – Arrêté du 18 juillet 2018
- Li J, Plorde JJ, Carlson LG. Effects of volume and periodicity on blood cultures. J Clin Microbiol. 1994 Nov;32(11):2829-31. doi: 10.1128/jcm.32.11.2829-2831.1994. PMID: 7852579; PMCID: PMC264167.
- Lamy B, Dargère S, Arendrup MC, Parienti JJ, Tattevin P. How to Optimize the Use of Blood Cultures for the Diagnosis of Bloodstream Infections? A State-of-the Art. Front Microbiol. 2016 May 12;7:697. doi: 10.3389/fmicb.2016.00697. PMID: 27242721; PMCID: PMC4863885.
- Jonsson B, Nyberg A, Henning C. Theoretical aspects of detection of bacteraemia as a function of the volume of blood cultured. APMIS. 1993 Aug;101(8):595-601. doi: 10.1111/j.1699-0463.1993.tb00152.x. PMID: 8217112.
- Société française de microbiologie « Référentiel en microbiologie médicale » 7e édition 2022
- Stohl S, Benenson S, Sviri S, Avidan A, Block C, Sprung CL, Levin PD. Blood cultures at central line insertion in the intensive care unit: comparison with peripheral venipuncture. J Clin Microbiol. 2011 Jul;49(7):2398-403. doi: 10.1128/JCM.02546-10. Epub 2011 Apr 27. PMID: 21525219; PMCID: PMC3147831.
- Snyder SR, Favoretto AM, Baetz RA, Derzon JH, Madison BM, Mass D, Shaw CS, Layfield CD, Christenson RH, Liebow EB. Effectiveness of practices to reduce blood culture contamination: a Laboratory Medicine Best Practices systematic review and meta-analysis. Clin Biochem. 2012 Sep;45(13-14):999-1011. doi: 10.1016/j.clinbiochem.2012.06.007. Epub 2012 Jun 16. PMID: 22709932; PMCID: PMC4518453.
- Synlab Provence « Guide de bonnes pratiques de prélèvement des flacons d’hémoculture » 25/10/2021
- Afnor « NF EN 13697 » 01/11/2023
- Laboratoire de biologie médicale « Bonnes pratiques de prélèvements des hémocultures » 21/02/2023
- Pittiruti, M., Van Boxtel, T., Scoppettuolo, G., Carr, P., Konstantinou, E., Ortiz Miluy, G., Lamperti, M., Goossens, G. A., Simcock, L., Dupont, C., Inwood, S., Bertoglio, S., Nicholson, J., Pinelli, F., & Pepe, G. (2023). European recommendations on the proper indication and use of peripheral venous access devices (the ERPIUP consensus): A WoCoVA project. The journal of vascular access, 24(1), 165–182.
- AFNOR Éditions « Gants de protection contre les produits chimiques dangereux et les micro-organismes – NF EN ISO 374-1 » février 2017
- CH des Chanaux « Hémocultures » 25/02/2020
- CPIAS « Recommandations pour le prélèvement des flacons d’hémoculture » 21/01/2013