La profession infirmière requiert une connaissance approfondie du corps humain et de ses processus.
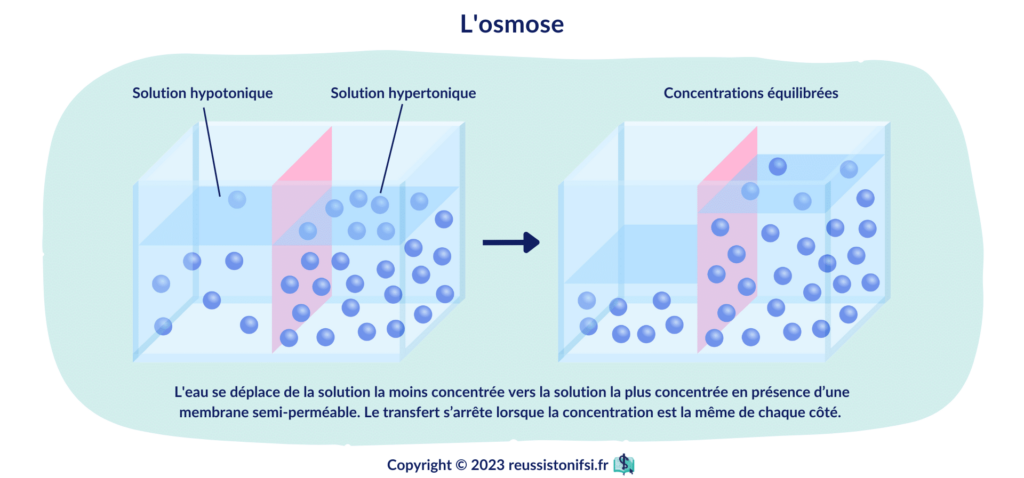
L’un des concepts essentiels est l’osmose, qui correspond au mouvement de fluides à travers une membrane semi-perméable.
Les infirmier(e)s doivent connaître les solutions isotoniques, hypotoniques et hypertoniques et savoir comment elles sont utilisées pour comprendre pourquoi le médecin prescrit un soluté spécifique.
Dans cet article, nous examinerons les fondamentaux de l’osmose et les caractéristiques des différents solutés.
Quelques définitions et description du principe de l’osmose
En sciences physiques :
Solvant : substance dans laquelle un soluté est dissous.
Soluté : substance dissoute dans un solvant. Le sel, le sucre et d’autres composés sont des exemples courants de solutés.
Solution : mélange de deux substances ou plus. Elle est composée d’un soluté, qui est la substance dissoute, et d’un solvant, qui est la substance dans laquelle le soluté est dissous.
En médecine1, on dit “soluté” pour nommer ce que les physiciens définissent comme une “solution”. Pour plus de clarté, et parce que c’est le langage qu’on utilisera dans le milieu médical, nous continuerons à utiliser le terme de “soluté”.
Osmose : « Phénomène de diffusion dans lequel une membrane entre deux liquides ou solutions laisse passer le solvant, mais non la substance dissoute. » 2
Osmolalité : « Teneur moléculaire, rapportée à l’unité de masse, de toutes les particules osmotiquement actives contenues dans une solution. » Elle est calculée en osm/kg. 3
Osmolarité : « Teneur moléculaire, rapportée à l’unité de volume, de toutes les particules osmotiquement actives contenues dans une solution. » Elle est calculée en osm/l.3
N.B. : 1 litre d’eau étant égal à 1 kg, l’osmolalité et l’osmolarité sont équivalentes.
Pour plus de clarté, nous n’utiliserons que le terme “osmolarité”.
Deux différences à comprendre
Quelle est la différence entre un remplissage et une hydratation ?
Les solutés utilisés pour un remplissage vasculaire permettent d’augmenter le volume de liquide dans le système circulatoire, tandis que les solutés utilisés pour une hydratation remplacent les liquides perdus à la suite d’une sudation excessive, de vomissements ou d’une diarrhée.
Quelle est la différence entre les secteurs intracellulaire, extracellulaire et vasculaire ?
- Le secteur intracellulaire est l’espace situé à l’intérieur d’une cellule. Cet espace est rempli d’organites, de protéines et d’autres molécules.
- Le secteur extracellulaire se situe à l’extérieur de la cellule et se compose de l’espace entre les cellules, ainsi que des substances présentes dans le liquide extracellulaire, telles que les hormones et les électrolytes.
- Le secteur vasculaire ou plasmatique fait référence au système circulatoire ou aux vaisseaux sanguins, qui transportent l’oxygène, les nutriments et les déchets dans tout le corps.
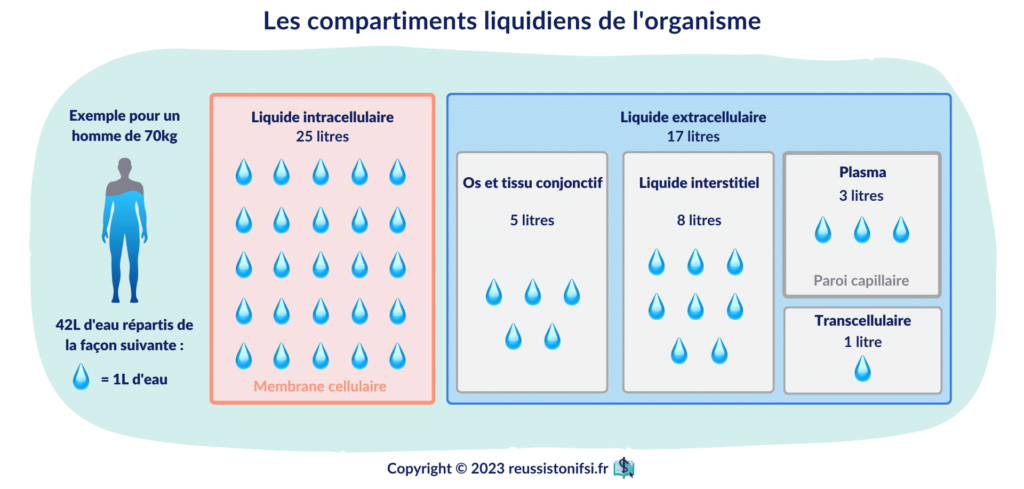
Pour rappel, l’eau constitue environ 60% du corps d’un adulte, ⅓ en extracellulaire et ⅔ en intracellulaire.
Les différents milieux
Avant de différencier les milieux iso, hyper et hypotonique, définissons la tonicité d’un produit.
La tonicité mesure la pression osmotique d’une solution, qui représente la quantité de pression nécessaire pour empêcher le mouvement des molécules d’eau à travers une membrane semi-perméable. La tonicité d’un produit est déterminée par la concentration des substances dissoutes qu’il contient.
Nous nous baserons sur la tonicité du plasma.
Le plasma étant la référence, il est dit isotonique à environ 300 mOsm/l.
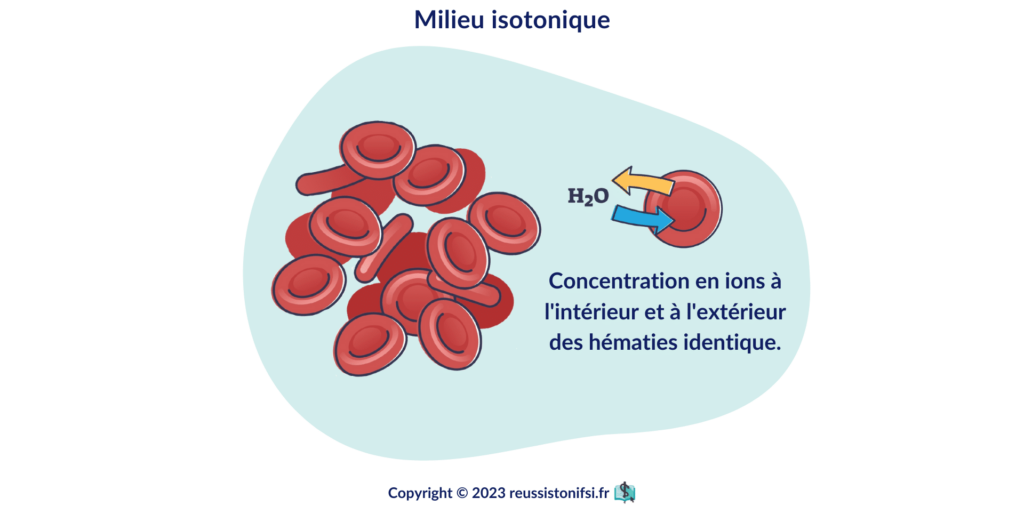
Milieu isotonique4
Entre 280 et 310 mOsm/l (même tonicité que le plasma).
Dans un milieu isotonique, il y a un équilibre des mouvements d’eau entre le milieu vasculaire et les globules rouges, donc l’osmolarité est la même. Il n’y a pas de mouvement d’eau massif d’un milieu à l’autre.
Dans un milieu isotonique, les globules rouges demeurent inchangés.
Exemples de solutés isotoniques et indications :
- NaCl 0,9% : hydratation, remplissage, produit de dilution pour certains médicaments.
- Ringer lactate : hydratation, remplissage vasculaire.
- Glucose 5% : hydratation, apport d’énergie, produit de dilution pour certains médicaments. Contre-indiqué pour les patients traumatisés crâniens ou en cas d’ischémie cérébrale, car il peut générer un œdème cérébral. Il est aussi complètement inadapté pour un remplissage vasculaire, car le glucose est vite consommé et stocké et l’eau diffusera rapidement hors du secteur vasculaire.
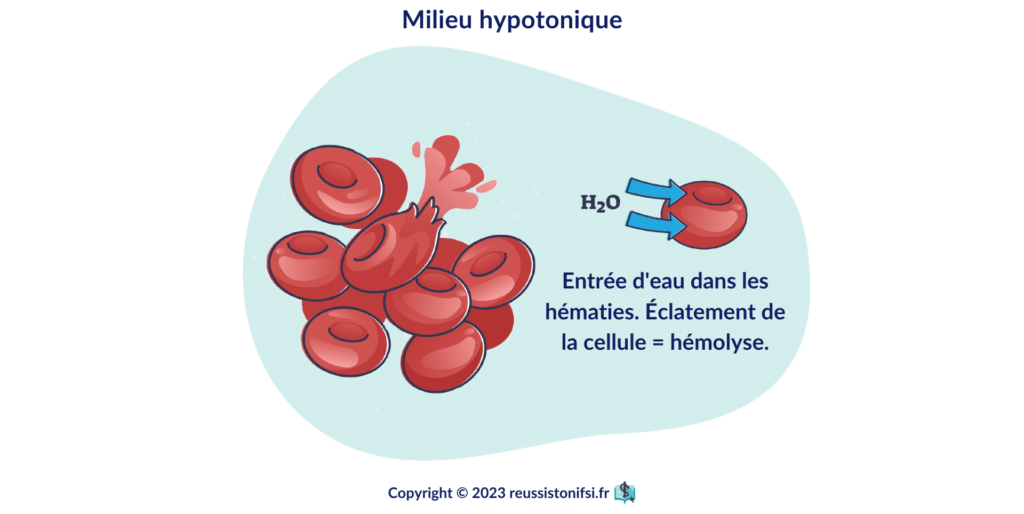
Milieu hypotonique4
Inférieur à 280 mOsm/l (plus dilué que le plasma).
Si le soluté injecté est moins concentré que le sang/plasma, alors le sang/plasma est dilué, et donc moins concentré que l’intérieur des globules rouges. L’eau se dirige du milieu le moins concentré vers le milieu le plus concentré : gonflement, puis hémolyse des globules rouges (ou de toutes les cellules en général).
Donc : ne jamais injecter de solutés hypotoniques en grands volumes ou en débit rapide.
Exemples de solutés hypotoniques et indications :
- Glucose 2,5% : réhydratation, patient diabétique.
- EPPI : eau stérile, pour dilution et reconstitution de produits injectables. Ne jamais injecter seule.
Dans un milieu hypotonique, les globules rouges deviennent turgescents et finissent par éclater. On appelle ce phénomène hémolyse.
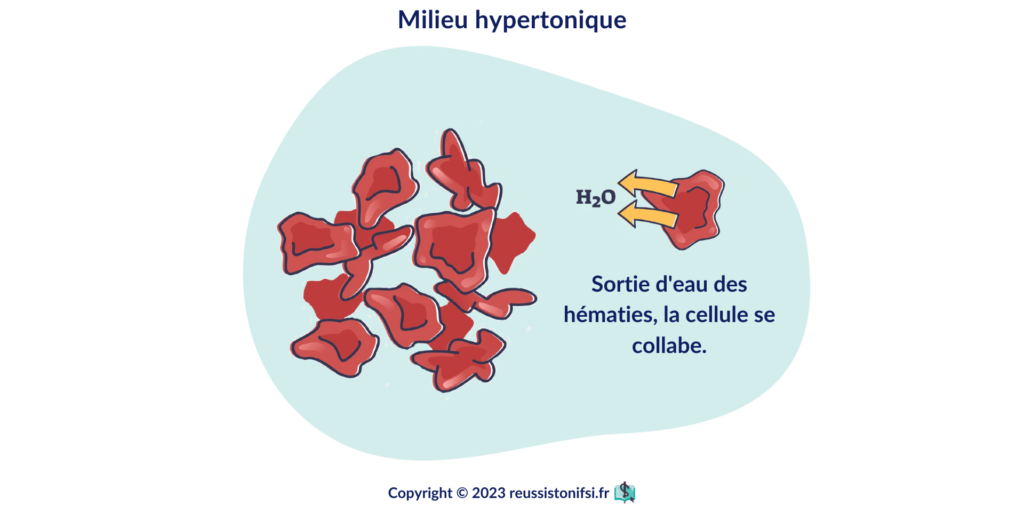
Milieu hypertonique4
Supérieur à 350 – 400 mOsm/l (plus concentré que le plasma).
Si le soluté injecté est hyper concentré (c’est-à-dire qu’il contient une forte concentration d’ions), le sang/plasma est plus concentré que l’intérieur des globules rouges. L’eau sort des cellules pour se diriger vers le plasma/sang, entraînant une déshydratation des globules rouges (ou des autres cellules).
Donc, ne pas injecter de solutés hypertoniques en grands volumes. Si l’on doit injecter de petits volumes hypertoniques, les diluer dans une perfusion isotonique ou à débit très lent.
Exemples de solutés hypertoniques et indications :
- Glucose 10% et 30% en cas d’hypoglycémie
- KCl 1 g/10 ml solution de potassium : hypokaliémie (NE JAMAIS INJECTER DU KCL EN BOLUS).
- Mannitol 10 ou 20% : œdème cérébral, hypertension intracrânienne.
- NaCl 7.5%, 10% et 20% : hyponatrémie.
Dans un milieu hypertonique, les globules rouges se déshydratent et deviennent crénelés.
Classement des solutés
Les solutés sont classés en deux grandes catégories 5:
Les cristalloïdes
Ces solutés sont composés d’eau et d’ions et contiennent de petites particules, tels que des sels minéraux et le glucose, qui peuvent rapidement passer dans le secteur interstitiel. Les cristalloïdes se répartissent vite dans les compartiments intracellulaires et extracellulaires.
| Les cristalloïdes | |
| Propriétés | Produits |
| Isotoniques | NaCl 0.9% (sérum physiologique) Glucose 5% Ringer lactate Bicarbonate de Sodium 1.4% |
| Hypertoniques | Nacl 7.5% (Sérumsalé) Glucose 10-15-20 et 30% Bicarbonate de sodium 4.2 et 8.4% Mannitol 10-20 et 25% |
| Hypotoniques | Glucose 2.5% |
Les colloïdes
Ces solutés sont composés de macromolécules qui restent dans les vaisseaux pendant un certain temps. Leur comportement est lié à leur pouvoir oncotique, c’est-à-dire la pression créée par les colloïdes par rapport au nombre de molécules qui ne passent pas la barrière vasculaire.
| Les colloïdes | |
| Propriétés | Produits |
| Gélatines | Gélofusine Plasmion |
| Hydroxyéthylamidon (HEA) | Voluven Héafusine 6 et 10% Hestéril |
| Dérivés du sang | Albumine |
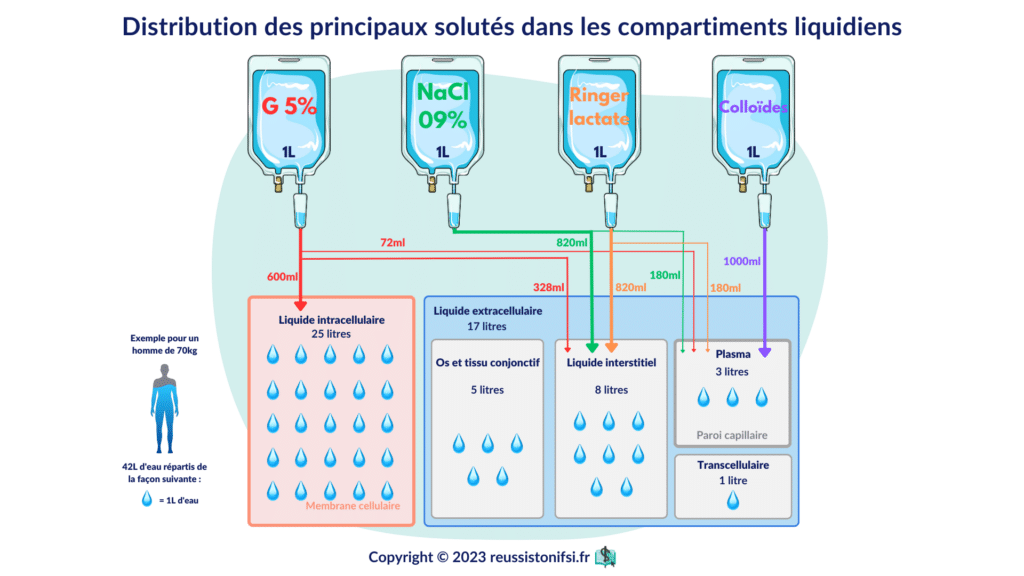
Si nous administrons 1 litre ou 1000 mL de G5% à ce patient pesant 70 kg, seulement 72 mL de cette solution iront dans le plasma, ce qui en fait un choix de liquide de remplissage peu adapté. Toutefois, plus de la moitié de la solution sera utilisée pour hydrater le secteur intracellulaire.
Si le but est de remplir le volume vasculaire, le médecin recommandera plutôt l’utilisation de NaCl 0.9%, car ce dernier a un pouvoir d’expansion plasmatique plus de deux fois supérieur à celui de G5%.6
Point sur les incompatibilités physico-chimiques
Les propriétés et les incompatibilités physico-chimiques sont importantes pour les infirmier(e)s lorsqu’ils/elles administrent des traitements. Les infirmier(e)s doivent s’assurer que les médicaments et les traitements administrés sont sûrs et efficaces. Connaître les incompatibilités est essentiel pour la prévention de réactions indésirables et pour s’assurer que les effets souhaités des médicaments et traitements soient atteints.
Les incompatibilités5 se manifestent par :
◦ La formation d’un précipité.
◦ Un changement de coloration.
◦ Un dégagement gazeux.
◦ Un changement de pH.
◦ Une diminution de la concentration en principe actif.
Les conséquences5 sont les suivantes :
◦ Obstruction des cathéters.
◦ Perte d’efficacité.
◦ Formation de dérivés toxiques.
◦ Risque d’embolie.
◦ Dépôt de cristaux dans certains organes (poumons).
Précautions infirmières7
Avant d’utiliser des solutions de perfusion, il est important de lire attentivement les étiquettes des flacons et de noter les médicaments ajoutés à la perfusion, ainsi que le nom et/ou le numéro de lit du patient. Lors de l’ajout de médicaments dans un flacon, il faut être conscient des risques d’incompatibilités physiques et chimiques, ainsi que de contamination. Il est également essentiel de vérifier la clarté de chaque flacon sous une source lumineuse et de rejeter tout flacon contenant des particules en suspension.
L’IDE a un rôle de compréhension, de vérification, de calcul de dose et de surveillance.
Comprendre les propriétés des solvants et des solutions permet d’identifier les effets secondaires possibles et d’adapter les surveillances.
Le produit est choisi par un médecin. Nous agissons sur prescription ou protocole.
Vous souhaitez en savoir davantage sur ces notions ?
Nous avons rédigé plusieurs cours sur le sujet sur la plateforme Réussis ton IFSI :
- U.E. 2.2 Semestre 1 : Homéostasie
- U.E. 4.4 Semestre 2 : Administration d’injectables
- U.E. 2.11 Semestre 3 : Les médicaments de l’urgence (solutions de remplissage)
Sources
- Dictionnaire Larousse, définition de « soluté » consulté le 23/03/23.
- Dictionnaire Le Robert, définition de « osmose » consulté le 23/03/23.
- Dictionnaire médical de l’Académie de Médecine « Osmolalité » – 2017.
- Réussis ton IFSI « Administration d’injectables » – [Cours appartenant à l’U.E. 4.4, Semestre 2], 2023.
- Dr Nadine OBOA du Centre Hospitalier Charles Foix – Jean Rostand AP-HP« Les solutés de perfusion et les électrolytes » – consulté le 23/03/23.
- Frost P. Intravenous fluid therapy in adult inpatients. BMJ. 2015 Jan 6;350:g7620. doi: 10.1136/bmj.g7620. PMID: 25569336.
- Médecins sans frontières « Utilisation des solutions de perfusion » – consulté le 23/03/23.